Como a acne e as espinhas são formadas?
Assim como a acne, a espinha é um problema muito comum entre os adolescentes e jovens. Mas o que acne? Como se forma a espinha? E por que é tão comum entre adolescentes e jovens?
Para se entender como se dá à formação da acne e da espinha, necessário se faz, lembrarmos da constituição da nossa pele. Ela se divide em camadas, a epiderme e a derme. A derme possui pequenos “alvéolos” denominadas de glândulas, são as glândulas sebáceas. Estas produzem uma secreção que é uma mistura complexa de lipídios, e é controlada por hormônios sexuais. Na puberdade a secreção sebácea é aumentada, devido à acelerada produção desses hormônios. Por isso este problema é mais característico nos adolescentes.
Quando ocorre uma produção excessiva dessa secreção, há uma obstrução nos “canais” dessas glândulas, ocasionando dessa forma a acne, que pode ser esbranquiçada ou enegrecido. Este local fica propício à proliferação de bactérias oportunistas que acabam infeccionando a região formando o que conhecemos como espinhas.
é um blog muito interessante feito pelos alunos de enfermagem da FITS Faculdade Integrada Tiradentes com o objetivo de desvendar a bioquimica que todos tanto temem . :)
terça-feira, 30 de novembro de 2010
METABOLISMO DE LIPÍDIOS
Os triagliceróis são os lipídios mais abundantes da dieta e constituem a forma de armazenamento de todo o excesso de nutrientes, quer este excesso seja ingerido sob a forma de carboidratos, proteínas ou dos próprios lipídios. Representam, portanto, a principal reserva energética do organismo, perfazendo, em média, 20% do peso corpóreo, o que equivale a uma massa 100 vezes maior do que a do glicogênio hepático. Os triagliceróis são armazenados nas células adiposas, sob forma anidra, e podem ocupar a maior parte do volume celular.
DEGRADAÇÃO DE TRIAGLICERÓIS E ÁCIDOS GRAXOS
A mobilização do depósito de triagliceróis é obtida por ação de lipases, presentes nos adipócitos, que hidrolisam os triacilgliceróis a ácidos graxos e glicerol, oxidados por vias diferentes.
O glicerol não pode ser reaproveitado pelos adipócitos, que não têm glicerol quinase, sendo então liberado no sangue. No fígado, por ação da glicerol quinase, é convertido a glicerol 3-fosfato e transformado em diidroxiacetona fosfato, um intermediário da glicose ou da gliconeogênese.
O gliceros não pode ser reaproveitado pelos adipócitos, que não têm glicerol quinase, sendo então liberado no sangue. No fígado, por ação da glicerol quinase, é convertido a glicerol 3-fosfato e transformado em diidroxiacetona fosfato, um intermediário da glicólise ou da glicogênese.
Os ácidos graxos liberados pelos adipócitos são transportados pelo sangue ligados à albumina e utilizados, principalmente pelo fígado e músculos, como fonte de energia. Sua degradação, como se verá a seguir, é feita por uma via especial, que se processa no interior das mitocôndrias.
Para sua oxidação, os ácidos graxos são ativados e transportados para a matriz mitocondrial
Em uma etapa que precede sua oxidação, as ácidos graxos são ativados por conversão a acil-CoA, por ação de acil-CoA sintetases, presentes na membrana externa da mitocôndria.
Nesta reação, forma-se uma ligação tioéster entre o grupo carboxila do ácido graxo e o grupo SH da coenzima. A, produzindo uma acil-CoA. As acil-CoA, como a acetil-CoA, são compostos ricos em energia: a energia derivada da clivagem do ATP em adenosina monofosfato (AMP) e pirofosfato inorgânico (PPi), com a quebra de uma ligação anidrido fosfórico, é utilizada para formar a ligação tioéster. O pirofosfato é hidrolisado a 2 Pi, numa reação irreversível, o que torna o processo de ativação do ácido graxo a acil-CoA também irreversível.
A membrana interna da mitocôndria é impermeável a coenzima A e a acil-CoA. Para a introdução dos radicais acila na matriz mitocondrial, é utilizado um sistema específico de transporte na face externa da membrana interna, a carnitina-acil transferase I transfere o radical acila para a carnitina, e, na face interna, a carnitina-acil transferase II doa o grupo acila da acil-carnitina para uma coenzima. A da matriz mitocondrial, liberando a carnitina.
A acil-CoA é oxidada a acetil-CoA, produzindo NADH e FADH2
A acil-CoA presente na matriz mitocondrial é oxidada por uma via denominada b-oxidação no ciclo de Lynen. Esta via consta de uma série cíclica de quatro reações, ao final das quais a acil-CoA é encurtada de dois carbonos, que são liberados sob a forma de acetil-CoA. As quatro reações são:
oxidação da acil-CoA a uma enoil-CoA (acil-CoA b-instaurada) de configuração trans com formação de FADH2;
hidratação da dupla ligação, formando o isômero L da 3-hidroxiacil-CoA;
oxidação do grupo hidroxila a carbonila, com formação de b-cetoacil-CoA e NADH;
quebra da b-cetoacil-CoA por uma molécula de CoA, com formação de acetil-CoA e uma acil-CoA com dois carbonos a menos; esta acil-CoA refaz o ciclo várias vezes, até ser totalmente convertida a acetil-CoA.
A oxidação do ácido palmítico produz 129 ATP
A oxidação completa de um ácido graxo exige a cooperação entre o ciclo de Lynen, que converte o ácido graxo a acetil-CoA, e o ciclo de Krebs, que oxida o radical acetil a CO2.
Em cada volta do ciclo de Lynen, há produção de 1 FADH2, 1 NADH, 1 acetil-CoA e 1 acil-CoA com dois átomos de carbono a menos que o ácido graxo original.
Sempre que o número de átomos de carbono do ácido graxo for par, a última volta do ciclo de oxidação inicia-se com uma acil-CoA de quatro carbonos, a butiril-CoA, e, neste caso, são produzidas 2 acetil-CoA, além de FADH2 e NADH.
O número de voltas percorridas por um ácido graxo até sua conversão total a acetil-CoA dependerá, naturalmente, do seu número de átomos de carbono. Assim sendo, para a oxidação completa de uma molécula de ácido palmítico, que tem 16 átomos de carbono, são necessárias sete voltas no ciclo, com a produção de 8 acetil-CoA. A oxidação de cada acetil-CoA no ciclo de Krebs origina 3 NADH, 1 FADH2 e 1 GTP. Pela fosforilação oxidativa completa do formam, respectivamente, 3 e 2 ATP. A produção de ATP formado (131) deve ser descontado o gasto inicial na reação de ativação do ácido graxo, onde há conversão de ATP e AMP + 2Pi e, portanto, consumo de duas ligações ricas em energia, o que equivaleria a um gasto de 2 ATP. O rendimento final da oxidação do ácido palmítico será, então, 129 ATP.
A b-oxidação dos ácidos graxos com número ímpar de átomos de carbono produz Propionil-CoA, que é convertida a succinil-CoA
Os ácidos graxos com número ímpar de átomos de carbono constituem uma pequena fração dos ácidos graxos da dieta e são também oxidados pela via da b-oxidação. Neste caso, entretanto a última volta do ciclo de Lynen inicia-se com uma acil-CoA de cinco carbonos e produz uma molécula de acetil-CoA e uma de propionil-CoA, ao invés de duas de acetil-CoA. Para sua oxidação, a propionil-CoA é convertida a succinil-CoA, análoga à carboxilação de piruvato a oxaloacetato e que também requer botina como coenzima. A conversão de D-metilmalonil-CoA a succinil-CoA é feita em duas etapas: transformação do isômero D em L e isomerização deste último composto utilizando 5+-adenosil-cobalamina, um derivado da vitamina B12, como coenzima.
A oxidação de ácidos insaturados também requer enzimas adicionais
Os ácidos graxos insaturados são muito comuns em tecidos animais e vegetais, e suas duplas reações apresentam quase sempre a configuração cis. Para sua oxidação, além das enzimas da oxidação, são necessárias duas enzimas adicionais: uma epimerase é uma isomerase.
Após a remoção de algumas unidades de dois carbonos (acetil-CoA) pelo ciclo de Lynen, o ácido graxo insaturado originará uma D -enoil-CoA ou uma D -enoil-CoA, segundo a posição original da dupla ligação no ácido graxo.
A cis-D -enoil-CoA é substrato para a enoil-CoA hidratase, mas o produto formado é o D-3-hidroxiacil-CoA, ao invés do isômero L, formado na oxidação de ácidos graxos saturados. A etapa seguinte é catalisada pela 3-hidroxiacil-CoA, que só reconhece isômeros L.
Portanto o isômero D deve ser convertido em L por ação de uma epimerase, para seguir as reações subseqüentes da b-oxidação.
O fitol, componente da clorofila, é oxidado por alfa e beta-oxidação
A clorofila é um componente quantitativamente importante da alimentação de muitos animais. Um dos substituíntes do núcleo pirrólico da clorofila é o fitol, um álcool com uma longa cadeia alifática, que pode ser oxidado a ácido fitânico, um componente minoritário de gorduras, leite e derivados. O ácido fitânico, por conter um radical metil no carbono b, não é reconhecido pela acil-CoA desidrogenase, que catalisa a primeira reação da b-oxidação. Esta situação é contornada pela hidroxilação do carbono a do ácido fitânico (a-oxidação), seguida por descarboxilação. O ácido pristânico produzido tem o radical metil agora no carbono a e apresenta o carbono b não-substanciado, podendo ser ativado e oxidado pelo ciclo de Lynen. Devido à presença dos radicais metil, a oxidação da pristanoil-CoA produz, alternadamente, propionil-CoA.
A deficiência hereditária de enzima que promove a a-oxidação resulta em acúmulo de ácido pristânico no sangue e nos tecidos, com lesão do sistema nervoso central (moléstia de Refsum)
No fígado, a acetil-CoA pode ser convertida a corpos cetônicos, oxidados por tecidos extra-hepáticos
No fígado, uma pequena quantidade de acetil-CoA é normalmente transformada em acetoacetato b-hidroxibutirato. Estes dois metabólitos e a acetona, formada espontaneamente pela descarboxilação do acetoacetato, são chamados em conjunto de corpos cetônicos, e sua síntese, de cetogênese. Esta ocorre na matriz mitocondrial, através da condensação de três moléculas de acetil-CoA em duas etapas. Na primeira, catalisada pela tiolase, duas moléculas de acetil-CoA originam acetoacetil-CoA. Esta reação, quando transcorre no sentido oposto, constitui a última reação da última volta do ciclo de Lynen. A reação de acetoacetil-CoA com uma terceira molécula de acetil-CoA forma 3-hidroxi-3-metilglutaril-CoA (HMG-CoA). Sua clivagem origina acetoacetato e acetil-CoA. O acetoacetato produz b-hidroxibutirato e acetona.
Os corpos cetônicos são liberados na corrente sangüínea, e o acetoacetato e o b-hidroxibutirato são aproveitados, principalmente pelo coração e músculos, como fonte de energia. Estes órgãos são capazes de utilizar os dois compostos por possuírem uma enzima, a b-cetoacil-CoA transferase, ausente do fígado. Esta enzima catalisa a transferência de CoA de succinil-CoA para acetoacetato, formando acetoacetil-CoA é um intermediário do ciclo de Lynen e, por ação da tiolase, é cindida em duas moléculas de acetil-CoA, que podem ser oxidadas pelo ciclo de Krebs. O aproveitamento do b-hidroxibutirato é feito por sua prévia transformação em acetoacetato, através da ação da b-hidroxibutirato desidrogenase.
A produção de corpos cetônicos é, portanto, um processo que permite a transferência de carbonos oxidáveis do fígado para outros órgãos. Esta produção é anormalmente alta quando a degradação de triagliceróis aumenta muito sem ser acompanhada por degradação proporcional de carboidratos. É o que ocorre quando há redução drástica da ingestão de carboidratos (jejum ou dieta) ou distúrbio de seu metabolismo (diabetes). Como a produção ultrapassa o aproveitamento pelos tecidos extra-hepáticos (cetose), os corpos cetônicos aparecem no plasma em concentração elevada (cetonemia), levando a uma acidose, isto é, uma diminuição do pH sangüíneo. Em casos de cetose acentuada, o cérebro pode obter parte da energia que necessita por oxidação dos corpos cetônicos.
O etanol é oxidado a acetil-CoA
O etanol ingerido pelo homem é prontamente absorvido e, no fígado, é oxidado a acetaldeído pela álcool desidrogenase citoplasmática, em uma reação idêntica à última etapa da fermentação alcoólica por leveduras:
O equilíbrio da reação favorece a formação de etanol, mas sua oxidação prossegue graças a conversão de acetaldeído em acetato, catalisada pela acetaldeído desidrogenase mitocondrial:
O acetato, à semelhança dos ácidos graxos, origina acetil-CoA por ação da acil-CoA sintetase. Neste ponto, o metabolismo do etanol confunde-se com o metabolismo de carboidratos, lipídios e proteínas, que também originam acetil-CoA. Deste modo, o consumo de quantidade discretas de etanol significa consumo adicional de calorias, que devem ser adicionadas às calorias derivadas na ingestão de nutrientes no cômputo das calorias totais da dieta. Todavia, a ingestão de grandes quantidades de etanol e, principalmente, o alcoolismo crônico têm conseqüências muito danosas para o organismo.
Alguns efeitos metabólicos do álcool no fígado são resultado da produção de níveis altos de NADH no citossol, onde normalmente a concentração de NAD+ é muito maior do que a de NADH. A alta concentração de NADH resultante da oxidação do etanol desloca a reação catalisada pela lactato desidrogenase no sentido da formação de lactato, cuja concentração pode aumentar de até cinco vezes, levando, portanto, a uma acidose. A baixa concentração de piruvato resultante impossibilita a gliconcogênese. Como, muitas vezes, a ingestão de álcool não é acompanhada de ingestão de nutrientes, pode ocorrer hipoglicemia e, finalmente, coma. A produção de acetil-CoA associada à baixa disponibilidade de glicose ocasiona cetose. Muitos efeitos metabólicos ao etanol ainda são compreendidos, especialmente aqueles que induzem a dependência.
SÍNTESE DE ÁCIDOS GRAXOS E TRIACILGLICERÓIS
Os ácidos graxos, constituíntes dos triacilgliceróis, podem diretamente da dieta ou serem sintetizados a partir de carboidratos, principalmente, e de proteínas. Neste último caso, os carboidratos e os aminoácidos são degradados até acetil-CoA e oxaloacetato. A síntese de ácidos graxos ocorre no citossol, para onde deve ser transportada a acetil-CoA formada em mitocôndria. Da condensação de acetil-CoA e oxaloacetato, forma-se citrato. Se a carga energética celular for alta (alta concentração de ATP), o citrato não pode ser oxidado pelo ciclo de Krebs em virtude da ambição da isocitrato desidrogenase e é transportado para a citossol, onde é cindido em oxaloacetato e acetil-CoA, à custa de ATP, numa reação catalisada pela citrato liase:
O oxaloacetato é reduzido a malato pela desidrogenase málica do citossol. O malato é substrato da enzima málica: nesta reação são produzidos piruvato, que retorna a mitocôndria, e NADPH.
A síntese de ácidos graxos tem malonil-CoA como doador de carbonos e NADPH como agente redutor
A síntese de ácidos graxos consiste na união seqüencial de unidades de dois carbonos: a primeira unidade é proveniente de acetil-CoA, e todas as subseqüentes, de malonil-CoA, formada por carboxilação de acetil-CoA. Esta reação é catalisada pela acetil-CoA, formada por carboxilação de acetil-CoA. Esta reação é catalisada pela acetil-CoA carboxilase, que tem como grupo prostético a biotina.
A síntese de ácidos graxos em bactérias e mamíferos processa-se através das mesmas reações catalisadas, todavia, por sistemas enzimáticos diferentes. A seguir será descrita a síntese em bactérias e, posteriormente, assinaladas as diferenças entre este sistema e o que ocorre em mamíferos.
Nas bactérias, as enzimas da síntese de ácidos graxos estão agrupadas em um complexo enzimático chamado sintase de ácidos graxos. Também faz parte deste complexo uma pequena proteína não enzimática, designada proteína carregadora de acila, ou ACP (“acyl-carrier protein”), à qual está sempre ligada a cadeia do ácido graxo em crescimento. O ACP tem como grupo prostético um derivado do ácido pantotênico: a fosfopanteteína, também componente da coenzima A.
A síntese inicia-se com a transferência do radical acetil da CoA para o ACP, catalisada pela primeira enzima do complexo: a acetil-CoA-ACP transacilase; este radical é, a seguir, transferido para o grupo SH de um resíduo de cisteína da Segunda enzima do complexo: a b-cetoacil-ACP sintase. O ACP, agora livre, pode receber o radical malonil da malonil-CoA, formado malonil-ACP. Segue-se uma condensação dos grupos acetil e malonil, catalisada pela b-cetoacil-ACP sintase (enzima de condensação), com liberação de CO2. Este CO2 é exatamente aquele usado para carboxilar a acetil-CoA a malonil-CoA. Por isso, apesar de CO2 ser imprescindível à síntese de ácidos graxos, seu átomo de carbono não aparece no produto. O fato de a condensação processar-se com uma descarboxilação faz com que esta reação seja acompanhada de uma grande queda de energia livre, dirigindo a reação no sentido da síntese. Justifica-se assim o gasto inicial de ATP para produzir malonil-CoA a partir de acetil-CoA: a utilização do percursor de três carbonos contorna a inviabilidade termodinâmica da condensação de duas moléculas de dois carbonos.
A b-cetoacil-ACP de quatro carbonos formada sofre uma redução, uma desidratação e nova redução. As reduções são catalisadas por redutases que usam NADPH como doador de elétrons. Neste ponto termina o primeiro ciclo de síntese, com a formação de um butiril-ACP. Deve-se notar que a seqüência das reações de síntese (condensação, redução, desidratação e redução) é inversa à seqüência das reações de oxidação de um ácido graxo pelo ciclo de Lynen (oxidação, hidratação, oxidação, quebra da cadeia carbônica). Os processos diferem, entretanto, quanto às enzimas e coenzimas que utilizam, o compartimento celular onde se processam e o suporte da cadeia carbônica (CoA ou ACP).
Para prosseguir o alongamento da cadeia, o radical butiril é transferido para o grupo SH da b- cetoacil-ACP sintase ( à semelhança do que ocorreu com o radical acetil), liberando o ACP, que recebe outro radical malonil. A repetição do ciclo leva à formação do hexanoil-ACP e, após mais cinco voltas, de palmitoil-ACP, que hidrolisado, libera o ácido palmítico.
Nos animais, a sintase de ácidos graxos é composta por apenas duas cadeias polipeptídicas idênticas, formando, portanto, um dímero do tipo a 2. A cada cadeia encontra-se associado um ACP. O que torna notável esta organização é o fato de estas cadeias polipeptídicas constituírem enzimas multifuncionais. Este termo é aplicado para designar cadeias polipeptídicas que apresentam várias atividades catalíticas, cada uma das quais associada a uma certa região da cadeia. Este é exatamente o caso da sintase de ácidos graxos dos animais, que apresentam, em cada cadeia peptídica, as atividades correspondentes às seguintes enzimas bacterianas: acetil-CoA-ACP transacilase, malonil-CoA-ACP transacilase, b-cetoacil-ACP redutase, b-cetoacil-ACP desidratase, enoil-ACP redutase e tioesterase. Esta última atividade é a responsável pela hidrólise final de palmitoil-ACP, liberando ácido palmítico. Uma comparação entre s atividades enzimáticas de cada monômero do complexo e as enzimas necessárias para a síntese de ácidos graxos em bactérias revela a ausência de atividade equivalente à da enzima de condensação (b-cetoacil-ACP sintase) no monômero. De fato, esta atividade só aparece no dímero funcional, pois depende de interações das duas cadeias peptídicas. A presença de enzimas multifuncionais associadas em um dímero traz, naturalmente, grande eficiência e economia ao processo de síntese, permitindo também a síntese simultânea de duas moléculas de palmitato, uma em cada monômero.
No total, a síntese de ácido palmítico (16 C) requer 1 acetil-CoA, 1 malonil-CoA, 14 NADPH e 7 ATP (consumidos na formação de 7 malonil-CoA a partir de 7 malonil-CoA). Os NADPH têm duas origens: provêem da reação catalisada pela enzima málica e das reações da via das pentoses-fosfato catalisadas por desidrogenases. A importância relativa entre essas duas fontes de poder redutor depende do tecido considerado.
O palmitato pode sofrer alongamento e insaturações. Alguns ácidos graxos insaturados são essenciais para os mamíferos
O ácido palmítico pode ser utilizado como percursor para a formação de ácidos graxos mais longos ou insaturados. Os sistemas enzimáticos incubidos dessas modificações situam-se no retículo endoplasmático.
O alongamento processa-se por reações muito semelhantes às da síntese de ácidos graxos. Os ácidos graxos com uma dupla ligação na posição D são sintetizados por um complexo enzimático que requer NADH e O2 e inclui o citocromo b5, firmemente ligado ao retículo endoplasmático. Este sistema produz os ácidos graxos monoinsaturados mais comuns nos tecidos animais: palmitoleico e oleico. Nos mamíferos, não há possibilidade de introdução de duplas ligações entre carbonos mais distantes da carboxila do que o C9. Os ácidos linoleico (C18 D) e a-linolênico ( C18 D) são, por isso, essenciais para o homem, isto é, devem ser obtidos pela dieta. A dessaturação adicional do ácido linoleico origina o ácido g-linolênico (C18 D) nos animais e o ácido a-linolênico (C18 D) nas plantas.
O ácido g-linolênico sofre alongamento de dois carbonos que resulta em alterações da posição das insaturações e formação de um intermediário C20 D. A quarta insaturação é introduzida entre os carbonos 5 e 6, originando o ácido araquidônico ( C20 D). Estas vias de dessaturação de ácidos graxos não estão totalmente elucidadas, mas admite-se que o ácido linoleico seja o único ácido graxo essencial para o homem; as necessidades de ácido a-linolênico são, ainda, obscuras.
O ácido araquidônico é percursor das prostaglandinas. As prostaglandinas compõe uma família de substâncias produzidas pela maioria das células dos mamíferos e que, atuando em concentrações tão baixas quanto os hormônios, regulam processos fisiológicos muito diversificados, como agregação de plaquetas, concentração de musculatura lisa, reação inflamatória etc.
Os percursores dos triacilgliceróis são glicerol 3-fosfato e acil-CoA
Os triacilgliceróis são sintetizados a partir de acil-CoA derivadas de ácidos graxos e glicerol 3-fosfato. O glicerol 3-fosfato é formado por redução de diidroxiacetona fosfato: obtida a partir de glicose. No fígado, existe uma via alternativa para obtenção de glicerol 3-fosfato: a fosforilação do glicerol, catalisada pela glicerol quinase. O glicerol 3-fosfato é acilado em duas etapas, formando fosfatidato, intermediário também da síntese de fosfolipídios. O triaglicerol é obtido por hidrólise do grupo fosfato do fosfatidato, seguida por nova acilação.
CONTROLE DA ATIVIDADE DIGESTIVA
A presença de alimento na boca, a simples visão, pensamento ou o cheiro do alimento, estimulam a produção de saliva.
Enquanto o alimento ainda está na boca, o sistema nervoso, por meio do nervo vago, envia estímulos ao estômago, iniciando a liberação de suco gástrico. Quando o alimento chega ao estômago, este começa a secretar gastrina (1), hormônio produzido pela própria mucosa gástrica e que estimula a produção do suco gástrico. Aproximadamente 30% da produção do suco gástrico é mediada pelo sistema nervoso, enquanto os 70% restantes dependem do estímulo da gastrina.
Com a passagem do alimento para o duodeno, a mucosa duodenal secreta outro hormônio, a secretina (2), que estimula o pâncreas a produzir suco pancreático e liberar bicarbonato.
Ao mesmo tempo, a mucosa duodenal produz colecistocinina (ou CCK) (3), que é estimulada principalmente pela presença de gorduras no quimo e provoca a secreção do suco pancreático e contração da vesícula biliar (4), que lança a bile no duodeno.
Em resposta ainda ao quimo rico em gordura, o duodeno secreta enterogastrona (5), que inibe os movimentos de esvaziamento do estômago, a produção de gastrina e, indiretamente, de suco gástrico.
O METABOLISMO DO COLESTEROL
Síntese do colesterol
Nos seres humanos, o colesterol pode ser sintetizado a partir do acetil-CoA. O fígado, seguido do intestino, são os principais locais da síntese do colesterol, podendo produzi-lo em grandes quantidades. Pode também ser produzido nos testículos, ovários e córtex adrenal.
Transporte de colesterol
O colesterol proveniente da dieta, chega ao fígado a partir de quilomícrons remanescentes e daí provoca a inibição da síntese da enzima da HMG-CoA redutase, diminuindo com isto a síntese endógena.
Antes de deixar os hepatócitos (células do fígado), o colesterol incorpora-se nas lipoproteínas VLDL (lipoproteína de densidade muito baixa). Estas, na corrente sanguínea, recebem as apoproteínas E e C2 das HDL (lipoproteína de alta densidade) e, ao passar pelos capilares dos tecidos periféricos, são transformadas em IDL (lipoproteína de densidade intermediária) e depois em LDL. Em indivíduos normais, aproximadamente metade das IDL retornam ao fígado, através dos receptores LDL, por endocitose (LDL e IDL contêm apoproteínas que se ligam especificamente aos receptores LDL – aproximadamente 1.500 receptores por célula), e os remanescentes IDL são convertidos em LDL.
Após ligação com LDL, a região da membrana contendo o complexo receptor-lipoproteína, invagina-se, migra através do citoplasma celular e funde-se lisossomos. A LDL é degradada nestas organelas e os ésteres de colesterol hidrolisados pela enzima colesterol-esterase lisossômica. O colesterol liberado é ressintetizado a éster dentro da célula e pode inibir a produção da redutase dentro de poucas horas, diminuindo com isto, a síntese do colesterol intracelular.
Regulação da síntese do colesterol
a- Inibição por “feed-back”: o colesterol proveniente da dieta inibe a síntese de colesterol no fígado, mas não no intestino, através da inibição da síntese da HMGCoA redutase.
b- Ritmo circadiano: a síntese de colesterol atinge o pico 6 horas após ter escurecido e o mínimo aproximadamente 6 horas após a reexposição à luz. A atividade é regulada ao nível da enzima HMGCoA redutase.
c- Regulação hormonal: insulina aumenta a atividade de HMGCoA redutase enquanto glucagon e cortisol inibem a atividade da enzima.
O COLESTEROL NO SANGUE
1- O colesterol forma um complexo com os lipídeos e proteínas, chamado lipoproteína. A forma que realmente apresenta malefício, quando em excesso, é a LDL.
2- Nesta interação, a LDL pode acabar sendo oxidada por radicais livres presentes na célula.
3- Esta oxidação aciona o mecanismo de defesa, desencadeando um processo inflamatório com infiltração de leucócitos. Moléculas inflamatórias acabam por promover a formação de uma capa de coágulos sobre o núcleo lipídico.
4- Após algum tempo cria-se uma placa (ateroma) no vaso sanguíneo; sobre esta placa, pode ocorrer uma lenta deposição de cálcio, numa tentativa de isolar a área afetada.
5- Isto pode interromper o fluxo sanguíneo normal (aterosclerose) e vir a provocar inúmeras doenças cardíacas. De fato, a concentração elevada de LDL no sangue é a principal causa de cardiopatias.
2- Nesta interação, a LDL pode acabar sendo oxidada por radicais livres presentes na célula.
3- Esta oxidação aciona o mecanismo de defesa, desencadeando um processo inflamatório com infiltração de leucócitos. Moléculas inflamatórias acabam por promover a formação de uma capa de coágulos sobre o núcleo lipídico.
4- Após algum tempo cria-se uma placa (ateroma) no vaso sanguíneo; sobre esta placa, pode ocorrer uma lenta deposição de cálcio, numa tentativa de isolar a área afetada.
5- Isto pode interromper o fluxo sanguíneo normal (aterosclerose) e vir a provocar inúmeras doenças cardíacas. De fato, a concentração elevada de LDL no sangue é a principal causa de cardiopatias.
LIPOPROTEÍNAS
As lipoproteínas são classificadas em várias classes, de acordo com a natureza e quantidade de lipídeos e proteínas que as constituem. Dentre as classes de lipoproteínas destacam-se:
- Quilomicrons: grandes partículas que transportam as gorduras alimentares e o colesterol para os músculos e outros tecidos.
- Very-Low Density Lipoproteins (VLDL) e Intermediate Density Lipoprotein (IDL): transportam triglicerídeos (TAG) e colesterol endógenos do fígado para os tecidos. A medida em que perdem triglicerídeos, podem coletar mais colesterol e tornarem-se LDL.
- Low-Density Lipoproteins (LDL): transportam do fígado para os tecidos, cerca de 70% de todo o colesterol que circula no sangue. São pequenas e densas o suficiente para se ligarem às membranas do endotélio (revestimento interno dos vasos sangüíneos. Por esta razão, as LDL são as lipoproteínas responsáveis pela aterosclerose (ver O colesterol no sangue) – deposição de placas lipídicas (ateromas) nas paredes das artérias. Conseqüentemente, níveis elevados de LDL estão associados com os altos índices de doenças cardiovasculares.
- High-Density Lipoproteins (HDL): é responsável pelo transporte reverso do colesterol ou seja, transporta o colesterol endógeno de volta para o fígado. O nível elevado de HDL está associado com baixos índices de doenças cardiovasculares.
Classes das enzimas
As enzimas podem ser classificadas de acordo com vários critérios. O mais importante foi estabelecido pela União Internacional de Bioquímica (IUB), e estabelece 6 classes:
- Oxidorredutases: São enzimas que catalisam reações de transferência de elétrons, ou seja: reações de oxi-redução. São as Desidrogenases e as Oxidases.

Se uma molécula se reduz, tem que haver outra que se oxide.
- Transferases : Enzimas que catalisam reações de transferência de grupamentos funcionais como grupos amina, fosfato, acil, carboxil, etc. Como exemplo temos as Quinases e as Transaminases.

- Hidrolases : Catalisam reações de hidrólise de ligação covalente. Ex: As peptidades.

- Liases: Catalisam a quebra de ligações covalentes e a remoção de moléculas de água, amônia e gás carbônico. As Dehidratases e as Descarboxilases são bons exemplos.

- Isomerases: Catalisam reações de interconversão entre isômeros ópticos ou geométricos. As Epimerases são exemplos.

- Ligases: Catalisam reações de formação e novas moléculas a partir da ligação entre duas já existentes, sempre às custas de energia (ATP). São as Sintetases.

Estruturas das Proteínas
As proteínas diferem entre si pelo número, tipo e seqüência dos aminoácidos em suas estruturas.
A seqüência linear de aminoácidos de uma proteína define sua estrutura primária.

O número de aminoácidos é muito variável de uma proteína para outra:
• Insulina bovina: 51 aminoácidos
• Hemoglobina humana: 574 aminoácidos
• Desidrogenase glutâmica: 8 300 aminoácidos
• Hemoglobina humana: 574 aminoácidos
• Desidrogenase glutâmica: 8 300 aminoácidos
O filamento de aminoácidos se enrola ao redor de um eixo, formando uma escada helicoidal chamada alfa-hélice. É uma estrutura estável, cujas voltas são mantidas por pontes de hidrogênio. Tal estrutura helicoidal é a estrutura secundária da proteína.
As proteínas estabelecem outros tipos de ligações entre suas partes. Com isto, dobram sobre si mesmas, adquirindo uma configuração espacial tridimensional chamada estrutura terciária. Essa configuração pode ser filamentar como no colágeno, ou globular, como nas enzimas.
Tanto o estabelecimento de pontes de hidrogênio como o de outros tipos de ligações dependem da seqüência de aminoácidos que compõem a proteína. Uma alteração na seqüência de aminoácidos (estrutura primária) implica em alterações nas estruturas secundária e terciária da proteína. Como a função de uma proteína se relaciona com sua forma espacial, também será alterada. Um exemplo clássico é a anemia falciforme. Nessa doença hereditária, há uma troca na cadeia de aminoácidos da hemoglobina (substituição de um ácido glutâmico por uma valina). Isto acaba por determinar mudanças na hemácia, célula que contém a hemoglobina, que assume o formato de foice quando submetida a baixas concentrações de oxigênio. 
Muitas proteínas são formadas pela associação de dois ou mais polipeptídeos (cadeias de aminoácidos). A maneira como estas cadeias se associam constitui a estrutura quaternária dessas proteínas. A hemoglobina, citada anteriormente, é formada pela união de duas cadeias "alfa" e duas cadeias "beta".
Embora o termo ponte de hidrogênio não seja adequado, ele é comumente empregado na bioquímica de proteínas. Quimicamente, este tipo de interação deveria ser chamado de ligação de hidrogênio, ao invés de ponte de hidrogênio.Desnaturação das Proteínas
Quando as proteínas são submetidas à elevação de temperatura, a variações de pH ou a certos solutos como a uréia, sofrem alterações na sua configuração espacial, e sua atividade biológica é perdida. Este processo se chama desnaturação. Ao romper as ligações originais, a proteína sofre novas dobras ao acaso. Geralmente, as proteínas se tornam insolúveis quando se desnaturam. É o que ocorre com a albumina da clara do ovo que, ao ser cozida, se torna sólida.

Na desnaturação, a seqüência de aminoácidos não se altera e nenhuma ligação peptídica é rompida. Isto demonstra que a atividade biológica de uma proteína não depende apenas da sua estrutura primária, embora esta seja o determinante da sua configuração espacial.
Algumas proteínas desnaturadas, ao serem devolvidas ao seu meio original, podem recobrar sua configuração espacial natural. Todavia, na maioria dos casos, nos processos de desnaturação por altas temperaturas ou por variações extremas de pH, as modificações são irreversíveis. A clara do ovo se solidifica, ao ser cozida, mas não se liquefaz quando esfria.
Enzimas cardíacas
Os marcadores de necrose miocárdica têm dupla função na avaliação do IAM, têm efeito diagnóstico e também na avaliação prognóstica. Em decorrência da isquemia prolongada a membrana celular perde sua integridade permitindo a saída para o meio extracelular de macromoléculas, possibilitando a dosagem sérica das mesmas. Dentre as mais importantes podemos citar:
Os marcadores de necrose miocárdica têm dupla função na avaliação do IAM, têm efeito diagnóstico e também na avaliação prognóstica. Em decorrência da isquemia prolongada a membrana celular perde sua integridade permitindo a saída para o meio extracelular de macromoléculas, possibilitando a dosagem sérica das mesmas. Dentre as mais importantes podemos citar:
- Creatinofosfoquinase (CK) e Fração MB da Creatinofosfoquinase (CK-MB). A CK-MB é mais específica para diagnóstico de necrose miocárdica, sendo sua curva característica, obtida pela dosagem seriada, padrão para diagnóstico de IAM.
- Troponinas T e I - não são detectadas em indivíduos normais, sendo que sua elevação, mesmo mínima, pode significar algum grau de lesão miocárdica (microinfartos). Uma dosagem negativa de troponina não afasta diagnóstico de IAM, devendo-se repetir essa avaliação após 10 a 12 horas do inicio dos sintomas.Pode se manter elevado até por 2 semanas do IAM.
- Mioglobina – seu principal papel no diagnóstico de IAM decorre de seu valor preditivo negativo (variando de 83% a 98%), ou seja, é um bom método complementar para se afastar a presença de infarto do miocárdio quando negativo - sua curva é feita apenas nas primeiras horas de dor torácica.
Alimentos e nutrientes
A matéria orgânica que constitui o alimento de um animal deve conter diversos tipos de substâncias nutrientes: carboidratos, lipídios, proteínas, sais minerais, vitaminas e água:- Carboidratos e lipídios - São nutrientes orgânicos cuja função principal é fornecer energia às células. Alimentos ricos nestes nutrientes costumam ser chamados de alimentos energéticos. Os carboidratos (ou Glicídios) estão presentes nas massas e açúcares e tem a função de produzir e armazenar energia. Já os lipídios são os óleos e as gorduras, tem a função de armazenar energia (reserva alimentar), manter a temperatura e dissolver algumas vitaminas.
- Proteínas - São nutrientes orgânicos cuja função principal é fornecer aminoácidos às células. A maior parte dos aminoácidos absorvidos é empregada na fabricação das proteínas específicas do animal. Uma vez que as proteínas são os principais constituintes estruturais das células animais, costuma-se dizer que alimentos ricos nesse tipo de nutriente são alimentos plásticos. As proteínas são construtoras de tecidos (ex.: unha, pele, músculos...) e catalisa reações bioquímicas (enzimas). Os aminoácidos estão contidos nas carnes e derivados do leite.
- Sais Minerais - São nutrientes inorgânicos que fornecem ao homem elementos químicos como o cálcio, o fósforo, o ferro ou o enxofre, entre outros. O cálcio por exemplo é um elemento químico de fundamental importância na estrutura dos ossos. O ferro, presente na hemoglobina do sangue de diversos animais, é fundamental para o transporte de oxigênio para as células. O fósforo faz parte da molécula de ATP, responsável pelo fornecimento de energia a todas as reações químicas fundamentais à vida.
- Água - Não é propriamente um nutriente, embora seja fundamental à vida. Todas as reações vitais ocorrem no meio aquoso presente no interior das células. Geralmente, a água faz parte da composição de todos os alimentos.
- Vitaminas - Substâncias orgânicas essenciais à vida, obtidas no alimento ingerido. A maioria das vitaminas atua como co-fatores enzimáticos, isto é, como fatores assessórios de reações catalisadas por enzimas. Na ausência de certas vitaminas, determinadas enzimas não funcionam, com prejuízo para as células. As doenças resultantes da falta de vitaminas são denominadas avitaminoses. Até hoje foram identificadas treze vitaminas que o homem necessita ingerir na dieta. O termo "vitamina" significa "amina vital".
Escorbuto e Beribéri
O escorbuto e o beribéri são exemplos de doenças causadas pela falta de vitaminas, substâncias que constituem uma classe especial de nutrientes essenciais.O escorbuto pode ser prevenido pela ingestão regular de frutas cítricas, como o limão ou a laranja. Sem o ácido ascórbico (substância conhecida como vitamina C), encontrada nessas frutas, a pessoa se torna enfraquecida, sofre de fortes hemorragias nasais e suas gengivas se inflamam; alguns podem até morrer.
O beribéri enfraquece os músculos, às vezes com total paralisia do corpo. Pode ser prevenido com uma dieta com tiamina, uma das vitaminas do complexo B, à base de vegetais, carne e arroz integral.
Necessidades energéticas
Um homem tem que despender energia constantemente para manter suas atividades vitais. A energia que supre as necessidades metabólicas é obtida através da respiração celular, processo composto por várias etapas bioquímicas, no qual moléculas orgânicas são oxidadas.A energia contida nos alimentos é geralmente medida em calorias (cal) ou em quilocalorias (kcal).
Taxas metabólicas
A quantidade de energia que um homem em repouso gasta para manter suas atividades vitais constitui sua taxa metabólica basal. Já a taxa metabólica total corresponde a quantidade de energia necessária à realização de todas as atividades de um organismo.A taxa metabólica basal de um homem jovem é cerca de 1600 kcal por dia. Já sua taxa metabólica total pode se situar em torno de 2000 kcal por dia, ou 6000 kcal por dia se ele for um atleta ou um trabalhador braçal.
Se ingerir quantidades insuficientes de nutrientes, ele ficará subnutrido. Com a perda de proteínas, os músculos se atrofiam. Mesmo proteínas de órgãos vitais, como o coração e o cérebro, passam a ser consumidas. As lesões físicas e mentais provocadas pela subnutrição podem ser irreversíveis, mesmo que se retorne à alimentação normal.

Dietas protetora e balanceada
Os cientistas calcularam que, além dos nutrientes fundamentais, é necessário um mínimo de 1300 kcal para que uma pessoa adulta sobreviva sem desnutrição. Essa dieta mínima foi denominada dieta protetora. Um exemplo da composição de alimentos da dieta protetora, para um período de 24 horas, seria:- 1/2 litro de leite;
- 20 gramas de trigo;
- 90 gramas de carneInternet;
- um ovo;
- três frutas;
- 5 gramas de manteiga;
- 200 gramas de verduras;
- 200 gramas de legumes;
- 90 gramas de pão integral;
- 50% a 60% de carboidratos,
- 25% a 35% de gorduras
- e cerca de 15% de proteínas.
A deficiência protéica na infância também pode ocorrer devido à suspensão precoce da amamentação natural, substituída por leite em pó. A amamentação no peito materno, além de fornecer uma dieta balanceada à criança, evita infecções intestinais e transfere imunidade a diversas doenças infecciosas.
proteinas e Doenças relacionadas
Proteínas e doenças cardiovasculares
Pensava-se que as dietas ricas em proteínas eram prejudiciais para o coração, mas os estudos mais recentes mostraram que ingerir grandes quantidades de proteínas não causa qualquer problema cardíaco, pelo contrário.É possível que comer maiores quantidades de proteínas, especialmente se forem de origem vegetal, ao mesmo tempo que cortamos nos carboidratos pode ser benéfico para o coração.
Proteínas e diabetes
As proteínas resultantes do leite de vaca também eram acusadas de desenvolver diabetes de tipo 1 (dependentes de insulina), mas os últimos estudos demonstram resultados inconclusivos e inconsistentes.A quantidade de proteínas na dieta não afecta negativamente o desenvolvimento da diabetes de tipo 2, mas aqui os estudos continuam a avançar lentamente.
Proteínas e cancro
Também não existe nenhuma evidência de que ingerir muita ou pouca proteína tenha efeitos no risco de cancro. Apesar disso, comer carne vermelha (com muitas quantidades de proteínas) está ligado ao aumento do risco de cancro no cólon.Proteínas e osteoporose
A digestão das proteínas liberta ácidos que são neutralizados pelo corpo através do cálcio e de outros agentes presentes no sangue. Comer muita proteína consome muito cálcio e algum dele pode vir dos ossos. Por isso, consumir muita quantidade de proteínas por largos períodos de tempo, pode enfraquecer os ossos. Apesar disso, os estudos também não são completamente conclusivos.Alguns estudos sugerem que o aumento de proteínas aumenta o risco de fracturas ósseas, enquanto outras associam as dietas ricas em proteínas com o aumento da densidade de minerais nos ossos.
Como se vê, as proteínas estão ainda a ser estudadas pela comunidade científica e ainda não existem respostas definitivas sobre muitos dos efeitos provocados pela ingestão excessiva de proteína.
terça-feira, 5 de outubro de 2010
Histamina
1 - AMINOÁCIDOS, PEPTÍDIOS, PROTEÍNAS:
1.1 Histamina:
A histamina foi incriminada como tendo participação em vários processos fisiológicos e farmacológicos. Foi proposta para o tratamento de numerosas síndromes clínicas, desempenha papel fisiológico na indução do trabalho de parto, na atividade secretora das glândulas gástricas e do pâncreas, na mediação química da percepção da dor cutânea, na hiperemia funcional etc. A histamina também foi proposta como o agente nocivo fundamental em vários fenômenos alérgicos, choques anafiláticos, toxemias das queimaduras e da gravidez, úlcera péptica e certos tipos de cefalalgia.
1.1 Histamina:
A histamina foi incriminada como tendo participação em vários processos fisiológicos e farmacológicos. Foi proposta para o tratamento de numerosas síndromes clínicas, desempenha papel fisiológico na indução do trabalho de parto, na atividade secretora das glândulas gástricas e do pâncreas, na mediação química da percepção da dor cutânea, na hiperemia funcional etc. A histamina também foi proposta como o agente nocivo fundamental em vários fenômenos alérgicos, choques anafiláticos, toxemias das queimaduras e da gravidez, úlcera péptica e certos tipos de cefalalgia.
Carboidratos (Monossacarídeos)
Monossacarídeos são sintetizados a partir de precursores menores derivados de CO2e H2O pela fotossíntese.
Classificação dos monossacarídeos
•De acordo com a natureza química de seu grupo carbonila e pelo número de seus átomos de carbono.
•Se o grupo carbonila for um aldeído, o açúcar será uma aldose.
•Algumas aldoses importantes são gliceraldeído, ribose, glicose, manose e galactose.
•Se o grupo carbonila for uma cetona, será uma cetose
•As cetoses mais comuns são aquelas com sua função de cetona no C2.
•As cetoses mais importantes: diidroxiacetona, ribulose e frutose.
•Compreedem as trioses, tetroses, pentoses, hexoses, heptoses.
Dentre as principais pentoses existentes destacam a ribose e desoxirribose que participam da síntese dos ácidos nucléicos. Dentre as hexoses destacam a frutose e a glicose importantes fontes de energia.
Classificação dos monossacarídeos
•De acordo com a natureza química de seu grupo carbonila e pelo número de seus átomos de carbono.
•Se o grupo carbonila for um aldeído, o açúcar será uma aldose.
•Algumas aldoses importantes são gliceraldeído, ribose, glicose, manose e galactose.
•Se o grupo carbonila for uma cetona, será uma cetose
•As cetoses mais comuns são aquelas com sua função de cetona no C2.
•As cetoses mais importantes: diidroxiacetona, ribulose e frutose.
•Compreedem as trioses, tetroses, pentoses, hexoses, heptoses.
Dentre as principais pentoses existentes destacam a ribose e desoxirribose que participam da síntese dos ácidos nucléicos. Dentre as hexoses destacam a frutose e a glicose importantes fontes de energia.
Reportagem sobre o "Dormir bem".
"Durma bem", mais uma vez
Quando os pais beijam seus filhos boa noite e dizer: "Dorme bem," é uma aposta justa que nenhuma das partes percebe que a frase teve origem na época da palha recheados com colchões. Antes da invenção dos colchões de mola, em 1865, da cama teria sido suspenso por reticulados corda que, quando cedido, poderá ser apertados com uma chave.
Bryson, a julgar pelos trechos de livros online pode ser visualizado, não faz quase tão grande um negócio dele, sua referência ao "durma bem" é apenas um parêntese ("daqui" durma bem ", a expressão"). Ainda assim, é muito ruim ver um escritor tão (justamente) popular espalhando a desinformação. No meu post anterior observou, a frase "durma bem", apareceu em 1860 - justamente quando os colchões de molas novos (! Assumindo que a data está correta) deveria ter começado a torná-lo obsoleto. "Durma bem" significa "dormir profundamente", e não há evidências de que tenha qualquer ligação com camas de corda.
Quando os pais beijam seus filhos boa noite e dizer: "Dorme bem," é uma aposta justa que nenhuma das partes percebe que a frase teve origem na época da palha recheados com colchões. Antes da invenção dos colchões de mola, em 1865, da cama teria sido suspenso por reticulados corda que, quando cedido, poderá ser apertados com uma chave.
Bryson, a julgar pelos trechos de livros online pode ser visualizado, não faz quase tão grande um negócio dele, sua referência ao "durma bem" é apenas um parêntese ("daqui" durma bem ", a expressão"). Ainda assim, é muito ruim ver um escritor tão (justamente) popular espalhando a desinformação. No meu post anterior observou, a frase "durma bem", apareceu em 1860 - justamente quando os colchões de molas novos (! Assumindo que a data está correta) deveria ter começado a torná-lo obsoleto. "Durma bem" significa "dormir profundamente", e não há evidências de que tenha qualquer ligação com camas de corda.
Mioma uterino
Mioma Uterino
--------------------------------------------------------------------------------
Os miomas, também chamados de fibromas ou leiomiomas,
são formações nodulares que se desenvolvem na parede
muscular do útero. Dependendo da sua localização, tamanho
e quantidade podem ocasionar problemas em algumas mulheres.
Tipicamente, os sintomas melhoram após a menopausa, quando
o nível de hormônios femininos diminui na circulação sanguínea.
Entretanto, mulheres que nesta fase utilizam reposição hormonal,
os sintomas podem continuar a aparecer. O tamanho dos miomas
pode variar desde pequeno a grandes formações que simulam
uma gravidez de 5 ou 6 meses. Os miomas são formados a partir
das células do tecido muscular da parede uterina chamado miométrio.
Podem ser vários ou um único mioma. A estatística mostra que uma
em cada 4 a 5 mulheres podem desenvolver o mioma. Já na raça
negra aparece numa proporção 3 vezes maior. Aparecem geralmente
em torno dos 30 a 40 anos de idade e diminuem com a menopausa.
Alguns miomas não requerem tratamento, porém quando causam
algum sintoma, devem ser tratados.
Tipos de Mioma
1. Subserosos: que se localizam na porção mais externa do útero e geralmente crescem para fora. Este tipo de mioma geralmente não afeta o fluxo menstrual, porém, podem tornar-se desconfortável pelo seu tamanho e pressão sobre outros órgãos da pélvis.
2. Intramurais: que crescem no interior da parede uterina e se expandem fazendo com que o útero aumente seu tamanho acima do normal. São os miomas mais comuns e geralmente provocam um intenso fluxo menstrual, dor pélvica ou sensação de peso.
3. Submucosos: que se localizam mais profundamente, bem abaixo da capa que reveste a cavidade uterina. São os miomas menos comuns mas provocam intensos e prolongados períodos menstruais.
Sintomas Típicos
· Períodos menstruais intensos e prolongados além de sangramentos mensais
típicos, por vezes com coágulos. Com frequência, isto pode levar a anemia.
· Dor pélvica.
· Pressão pélvica ou sensação de peso.
· Dor nas costas ou pernas.
· Dor nas relações sexuais.
· Sensação de pressão na bexiga com vontade constante de urinar.
· Pressão no intestino que leva a constipação ou distensão.
· Crescimento anormal do abdomem inferior.
Opções de Tratamento
A maioria dos miomas não exige tratamento, se a paciente não apresentar nenhum dos sintomas descritos, pois os miomas são lesões benignas.
1. Tratamento Clínico
a terapia medicamentosa é o primeiro passo no tratamento. Medicamentos que auxiliam a coagulação, antiinflamatórios não hormonais ou compostos hormonais podem ser usados nesta fase e, na maioria das vezes, são suficientes para controlar os sintomas sem precisar de terapia adicional. Alguns compostos hormonais apresentam certos efeitos colaterais e outros riscos, quando utilizados a longo prazo e, por isso, geralmente, são indicados temporariamente. Deve-se salientar, que os miomas geralmente voltam a crescer quando a terapia medicamentosa é descontinuada. Quando o tratamento com medicamentos falha o próximo passo é tentar uma terapia mais invasiva.
2. Embolização da Artéria uterina
ver mais detalhes no item Embolização -
Este novo procedimento não cirúrgico consiste na introdução de um pequeno tubo plástico de 2 milímetros denominado cateter ma artéria que passa pela virilha. Este cateter será conduzido por dentro das artérias até alcançar as que se dirigem para o útero e os miomas. Nesta posição são injetadas pequenas partículas plásticas que ocluem a passagem de sangue para o mioma causando o seu encolhimento.
3. Miomectomia
É um procedimento cirúrgico que remove somente o mioma, não todo o útero, preservando assim a capacidade da mulher para engravidar. Há várias técnicas para realizar a miomectomia, que incluem: a via histeroscópia, a via laparoscópia ou a via abdominal.
3.1 Miomectomia por via histeroscópia
é utilizada somente para extrair os miomas que se encontram por debaixo da camada interna do útero e se exteriorizam para a cavidade uterina. Não se requer qualquer incisão cirúrgia. O médico introduz um tubo flexível chamado histeroscópio através da vagina e colo uterino e com instrumentos apropriados extrai o mioma. Este procedimento é realizado geralmente de forma ambulatorial e com anestesia.
3.2 Miomectomia Laparoscópica
é utilizada para extrair miomas que se encontram na porção externa do útero. Pequenas incisões são realizadas na parede abdominal por onde são introduzidos uma micro câmara de vídeo e instrumentos apropriados para realizar a extração do mioma. Este procedimento é realizado com anestesia geral.
3.3 Miomectomia abdominal
é um procedimento cirúrgico formal que consiste na realização de uma incisão na parede abdominal para aceder ao útero e uma outra incisão no útero para extrair o mioma. Após a retirada do mioma do útero é suturado. Esta cirurgia requer anestesia geral e geralmente vários dias de hospitalização. A miomectomia é frequentemente bem sucedida para controlar os sintomas, porém, quanto maior número de miomas tiver no útero, menor sucesso terá a cirurgia. Adicionalmente, os miomas podem voltar a crescer alguns anos após a miomectomia.
4. Histerectomia
Aproximadamente 1/3 das milhões de histerectomias realizadas anualmente no mundo todo são devidas a mioma uterino. Histerectomia é a remoção cirúrgica do útero que pode ser realizada por via vaginal, laparoscópia ou abdominal como é mais convencional. Este procedimento cirúrgico requer anestesia geral, demanda três ou quatro dias de hospitalização e quatro a seis semanas de recuperação. A histerectomia atualmente é feita, em último caso, quando há complicações severas para a mulher.
"... são formações nodulares que se desenvolvem na parede muscular do útero".
Tipos de mioma
Sintomas Tipicos
Opções de tratamento
Imagem 1:
Tipos de Mioma
--------------------------------------------------------------------------------
Os miomas, também chamados de fibromas ou leiomiomas,
são formações nodulares que se desenvolvem na parede
muscular do útero. Dependendo da sua localização, tamanho
e quantidade podem ocasionar problemas em algumas mulheres.
Tipicamente, os sintomas melhoram após a menopausa, quando
o nível de hormônios femininos diminui na circulação sanguínea.
Entretanto, mulheres que nesta fase utilizam reposição hormonal,
os sintomas podem continuar a aparecer. O tamanho dos miomas
pode variar desde pequeno a grandes formações que simulam
uma gravidez de 5 ou 6 meses. Os miomas são formados a partir
das células do tecido muscular da parede uterina chamado miométrio.
Podem ser vários ou um único mioma. A estatística mostra que uma
em cada 4 a 5 mulheres podem desenvolver o mioma. Já na raça
negra aparece numa proporção 3 vezes maior. Aparecem geralmente
em torno dos 30 a 40 anos de idade e diminuem com a menopausa.
Alguns miomas não requerem tratamento, porém quando causam
algum sintoma, devem ser tratados.
Tipos de Mioma
1. Subserosos: que se localizam na porção mais externa do útero e geralmente crescem para fora. Este tipo de mioma geralmente não afeta o fluxo menstrual, porém, podem tornar-se desconfortável pelo seu tamanho e pressão sobre outros órgãos da pélvis.
2. Intramurais: que crescem no interior da parede uterina e se expandem fazendo com que o útero aumente seu tamanho acima do normal. São os miomas mais comuns e geralmente provocam um intenso fluxo menstrual, dor pélvica ou sensação de peso.
3. Submucosos: que se localizam mais profundamente, bem abaixo da capa que reveste a cavidade uterina. São os miomas menos comuns mas provocam intensos e prolongados períodos menstruais.
Sintomas Típicos
· Períodos menstruais intensos e prolongados além de sangramentos mensais
típicos, por vezes com coágulos. Com frequência, isto pode levar a anemia.
· Dor pélvica.
· Pressão pélvica ou sensação de peso.
· Dor nas costas ou pernas.
· Dor nas relações sexuais.
· Sensação de pressão na bexiga com vontade constante de urinar.
· Pressão no intestino que leva a constipação ou distensão.
· Crescimento anormal do abdomem inferior.
Opções de Tratamento
A maioria dos miomas não exige tratamento, se a paciente não apresentar nenhum dos sintomas descritos, pois os miomas são lesões benignas.
1. Tratamento Clínico
a terapia medicamentosa é o primeiro passo no tratamento. Medicamentos que auxiliam a coagulação, antiinflamatórios não hormonais ou compostos hormonais podem ser usados nesta fase e, na maioria das vezes, são suficientes para controlar os sintomas sem precisar de terapia adicional. Alguns compostos hormonais apresentam certos efeitos colaterais e outros riscos, quando utilizados a longo prazo e, por isso, geralmente, são indicados temporariamente. Deve-se salientar, que os miomas geralmente voltam a crescer quando a terapia medicamentosa é descontinuada. Quando o tratamento com medicamentos falha o próximo passo é tentar uma terapia mais invasiva.
2. Embolização da Artéria uterina
ver mais detalhes no item Embolização -
Este novo procedimento não cirúrgico consiste na introdução de um pequeno tubo plástico de 2 milímetros denominado cateter ma artéria que passa pela virilha. Este cateter será conduzido por dentro das artérias até alcançar as que se dirigem para o útero e os miomas. Nesta posição são injetadas pequenas partículas plásticas que ocluem a passagem de sangue para o mioma causando o seu encolhimento.
3. Miomectomia
É um procedimento cirúrgico que remove somente o mioma, não todo o útero, preservando assim a capacidade da mulher para engravidar. Há várias técnicas para realizar a miomectomia, que incluem: a via histeroscópia, a via laparoscópia ou a via abdominal.
3.1 Miomectomia por via histeroscópia
é utilizada somente para extrair os miomas que se encontram por debaixo da camada interna do útero e se exteriorizam para a cavidade uterina. Não se requer qualquer incisão cirúrgia. O médico introduz um tubo flexível chamado histeroscópio através da vagina e colo uterino e com instrumentos apropriados extrai o mioma. Este procedimento é realizado geralmente de forma ambulatorial e com anestesia.
3.2 Miomectomia Laparoscópica
é utilizada para extrair miomas que se encontram na porção externa do útero. Pequenas incisões são realizadas na parede abdominal por onde são introduzidos uma micro câmara de vídeo e instrumentos apropriados para realizar a extração do mioma. Este procedimento é realizado com anestesia geral.
3.3 Miomectomia abdominal
é um procedimento cirúrgico formal que consiste na realização de uma incisão na parede abdominal para aceder ao útero e uma outra incisão no útero para extrair o mioma. Após a retirada do mioma do útero é suturado. Esta cirurgia requer anestesia geral e geralmente vários dias de hospitalização. A miomectomia é frequentemente bem sucedida para controlar os sintomas, porém, quanto maior número de miomas tiver no útero, menor sucesso terá a cirurgia. Adicionalmente, os miomas podem voltar a crescer alguns anos após a miomectomia.
4. Histerectomia
Aproximadamente 1/3 das milhões de histerectomias realizadas anualmente no mundo todo são devidas a mioma uterino. Histerectomia é a remoção cirúrgica do útero que pode ser realizada por via vaginal, laparoscópia ou abdominal como é mais convencional. Este procedimento cirúrgico requer anestesia geral, demanda três ou quatro dias de hospitalização e quatro a seis semanas de recuperação. A histerectomia atualmente é feita, em último caso, quando há complicações severas para a mulher.
"... são formações nodulares que se desenvolvem na parede muscular do útero".
Tipos de mioma
Sintomas Tipicos
Opções de tratamento
Imagem 1:
Tipos de Mioma
Vejam qts congressos estao pra acontecer!!!!!Otimos
http://bvsms.saude.gov.br/direve/xmlListT.php?xml[]=http://bvsms.saude.gov.br/cgi-bin/wxis.exe/?IsisScript=direve/main.xis|lang=pt&xsl=xsl/direve-main.xsl&lang=pt&xml[]=GET
sexta-feira, 1 de outubro de 2010
abordagem sindrômica
O ESPAÇO ENFERMAGEM TRÁS PARA MACEIÓ PELA PRIMEIRA VEZ !
CURSO DE ABORDAGEM SINDRÔMICA E DIAGNÓSTICO MOLECULAR DAS ISTs (DSTs)
Instrutores Oficiais:
Kilma Rocha (Enfermeira – Universidade de Pernambuco)
Eduardo Ramalho (Geneticista Molecular – University of London)
POR QUE ABORDAGEM SINDRÔMICA?
Desde 1991, a Organização Mundial de Saúde (OMS) introduziu o conceito de abordagem sindrômica para atendimento do portador de DST,hoje chamada de IST. O método consiste em incluir a doença dentro de síndromes pré-estabelecidas, baseadas em sintomas e sinais, e instituir tratamento imediato sem aguardar resultados de exames confirmatórios. É seguir um protocolo terapêutico, no formato de fluxograma ou algoritmo, assim como outras estratégias, por exemplo o AIDPI.
As DST genitais estão distribuídas em cinco síndromes: corrimentos uretrais, úlceras genitais, corrimentos vaginais, dor pélvica e verrugas genitais. Devido a não haver equivalente para a região anorretal, propomos três síndromes: úlceras perianais, retites e verrugas perianais.
A redução de 40% na incidência de HPV e câncer uterino foi observada na população brasileira em pessoas cuja abordagem das DST foi feita de maneira sindrômica.
Como trata-se de protocolo nacional, o enfermeiro, com posse da certificação oficial, tem competência legal para realizar diagnóstico com base nos sinais e sintomas e terapêutica medicamentosa ou não, com base nos algoritmos.
Nosso curso vai além, e este é o nosso diferencial. Escolhemos uma das doenças mais prevalentes (HPV), e no segundo módulo, o aluno vai ter a oportunidade de entender o diagnóstico molecular desta doença, e como ela pode desencadear o câncer de colo uterino.
PÚBLICO-ALVO: Enfermeiros, Médicos, Biomédicos, acadêmicos destas profissões
CARGA HORÁRIA DO CERTIFICADO: 80 horas/aula
HORÁRIOS: 2 finais de semana
INVESTIMENTO: 2x DE R$ 150,00 OU À VISTA EM R$ 295,00
CONTEÚDO: - DST NO BRASIL
- ABORDAGEM INTEGRAL AO PORTADOR DE DST
- ABORDAGEM DOS PARCEIROS SEXUAIS: ACONSELHAMENTO
- SINAIS E SINTOMAS DAS DSTs: COMO DIAGNOSTICAR (PRÁTICA COM CASOS)
- ALGORÍTMOS E FLUXOGRAMAS: COMO TRATAR (PRÁTICA COM CASOS)
- O HPV NO BRASIL
- EXTRAÇÃO DE DNA DE AMOSTRAS DE HPV (PRÁTICA DE LABORATÓRIO)
- ELETROFORESE E AMPLIFICAÇÃO POR MEIO DE PCR DE AMOSTRAS DE HPV (PRÁTICA DE LABORATÓRIO)
- HPV E CÂNCER DE COLO UTERINO
LIGUE AGORA!
ESPAÇO ENFERMAGEM
CENTRO DE APERFEIÇOAMENTO PROFISSIONAL
Fone/FAX: (82) 3221 9156 / (82) 8852.5408 / (82) 8856.0351
SEDE MACEIÓ: Av. Dr. Júlio Marques Luz, 1013 - Galeria Jatiúca Center - Jatiúca
Email: espacoenfermagemmaceio2008@hotmail.com
Orkut: Espaço Enfermagem Maceió
WWW.ESPACOENFERMAGEM.COM.BR
CURSO DE ABORDAGEM SINDRÔMICA E DIAGNÓSTICO MOLECULAR DAS ISTs (DSTs)
Instrutores Oficiais:
Kilma Rocha (Enfermeira – Universidade de Pernambuco)
Eduardo Ramalho (Geneticista Molecular – University of London)
POR QUE ABORDAGEM SINDRÔMICA?
Desde 1991, a Organização Mundial de Saúde (OMS) introduziu o conceito de abordagem sindrômica para atendimento do portador de DST,hoje chamada de IST. O método consiste em incluir a doença dentro de síndromes pré-estabelecidas, baseadas em sintomas e sinais, e instituir tratamento imediato sem aguardar resultados de exames confirmatórios. É seguir um protocolo terapêutico, no formato de fluxograma ou algoritmo, assim como outras estratégias, por exemplo o AIDPI.
As DST genitais estão distribuídas em cinco síndromes: corrimentos uretrais, úlceras genitais, corrimentos vaginais, dor pélvica e verrugas genitais. Devido a não haver equivalente para a região anorretal, propomos três síndromes: úlceras perianais, retites e verrugas perianais.
A redução de 40% na incidência de HPV e câncer uterino foi observada na população brasileira em pessoas cuja abordagem das DST foi feita de maneira sindrômica.
Como trata-se de protocolo nacional, o enfermeiro, com posse da certificação oficial, tem competência legal para realizar diagnóstico com base nos sinais e sintomas e terapêutica medicamentosa ou não, com base nos algoritmos.
Nosso curso vai além, e este é o nosso diferencial. Escolhemos uma das doenças mais prevalentes (HPV), e no segundo módulo, o aluno vai ter a oportunidade de entender o diagnóstico molecular desta doença, e como ela pode desencadear o câncer de colo uterino.
PÚBLICO-ALVO: Enfermeiros, Médicos, Biomédicos, acadêmicos destas profissões
CARGA HORÁRIA DO CERTIFICADO: 80 horas/aula
HORÁRIOS: 2 finais de semana
INVESTIMENTO: 2x DE R$ 150,00 OU À VISTA EM R$ 295,00
CONTEÚDO: - DST NO BRASIL
- ABORDAGEM INTEGRAL AO PORTADOR DE DST
- ABORDAGEM DOS PARCEIROS SEXUAIS: ACONSELHAMENTO
- SINAIS E SINTOMAS DAS DSTs: COMO DIAGNOSTICAR (PRÁTICA COM CASOS)
- ALGORÍTMOS E FLUXOGRAMAS: COMO TRATAR (PRÁTICA COM CASOS)
- O HPV NO BRASIL
- EXTRAÇÃO DE DNA DE AMOSTRAS DE HPV (PRÁTICA DE LABORATÓRIO)
- ELETROFORESE E AMPLIFICAÇÃO POR MEIO DE PCR DE AMOSTRAS DE HPV (PRÁTICA DE LABORATÓRIO)
- HPV E CÂNCER DE COLO UTERINO
LIGUE AGORA!
ESPAÇO ENFERMAGEM
CENTRO DE APERFEIÇOAMENTO PROFISSIONAL
Fone/FAX: (82) 3221 9156 / (82) 8852.5408 / (82) 8856.0351
SEDE MACEIÓ: Av. Dr. Júlio Marques Luz, 1013 - Galeria Jatiúca Center - Jatiúca
Email: espacoenfermagemmaceio2008@hotmail.com
Orkut: Espaço Enfermagem Maceió
WWW.ESPACOENFERMAGEM.COM.BR
minha musica preferida
Tá Vendo Aquela Lua
Exaltasamba
Composição: Thiaguinho / Pezinho
Te filmando, eu tava quieto no meu canto
Cabelo bem cortado, perfume exalando
Daquele jeito que eu sei que você gosta
Mas eu te dei um papo, e você nem deu resposta
Tudo bem um dia vai o outro vem
Você deve estar pensando em outro alguém
Mas se ele te merecesse não estaria aqui
Não, não, não
Ou talvez você não queira se envolver
Magoada ta com medo de sofrer
Se me der uma chance não vai se arrepender
Não, não, não,não,não
Tá vendo aquela lua, que brilha lá no céu
Se você me pedir eu vou buscar, só pra te dar
Se bem que o brilho dela, nem se compara ao seu
Deixa eu te dar um beijo, vou mostrar o tempo que perdeu
Que coisa louca, eu já sabia
Enquanto eu me arrumava algo me dizia
Você vai encontrar alguém que vai mudar
A sua vida inteira da noite pro dia
Exaltasamba
Composição: Thiaguinho / Pezinho
Te filmando, eu tava quieto no meu canto
Cabelo bem cortado, perfume exalando
Daquele jeito que eu sei que você gosta
Mas eu te dei um papo, e você nem deu resposta
Tudo bem um dia vai o outro vem
Você deve estar pensando em outro alguém
Mas se ele te merecesse não estaria aqui
Não, não, não
Ou talvez você não queira se envolver
Magoada ta com medo de sofrer
Se me der uma chance não vai se arrepender
Não, não, não,não,não
Tá vendo aquela lua, que brilha lá no céu
Se você me pedir eu vou buscar, só pra te dar
Se bem que o brilho dela, nem se compara ao seu
Deixa eu te dar um beijo, vou mostrar o tempo que perdeu
Que coisa louca, eu já sabia
Enquanto eu me arrumava algo me dizia
Você vai encontrar alguém que vai mudar
A sua vida inteira da noite pro dia
curso do espaço de enfermagem
Olá!
Segue nosso informativo de cursos. Em anexo segue a ficha de inscrição; no caso de inscrição, favor preencher a ficha e nos reenviar para garantirmos a vaga.
INSCRIÇÕES ABERTAS P/ OS CURSOS LIVRES:
APERFEIÇOAMENTO EM URGÊNCIA E EMERGÊNCIA - 2ª TURMA
Início: 10 de Dezembro (1 FDS por mês, durante 6 meses)
Carga Horária: 240h
Investimento: 6 x de R$ 110,00
CATETERISMO UMBILICAL
Início: 15, 16 e 17 de outubro
Carga Horária: 40h
Investimento: À vista R$ 380,00 ou em 3 x no cheque
PUNÇÃO VENOSA
Início: 6, 7, 8 e 9 de dezembro
Carga Horária: 40h
Investimento: R$ 150,00
ABORDAGEM SINDRÔMICA
Início: 5, 6 e 7 e 26, 27 e 28 de novembro
Carga Horária: 80h
Investimento: R$ 295,00
PÓS-GRADUAÇÃO:
Pós-graduação em Pediatria e Neonatologia
Início: 22, 23 e 24 de outubro
Carga horária: 432h
Investimento: 15 x de R$ 290,00 ou 20 x de R$ 217,00
Pós-graduação em Enfermagem do Trabalho
Início: 3, 4 e 5 de dezembro
Carga horária: 432h
Investimento: 15 x de R$ 290,00 ou 20 x de R$ 217,00
OBS.: GRUPOS A PARTIR DE 5 PESSOAS, CONCEDEMOS DESCONTO NOS VALORES/MENSALIDADES DOS CURSOS.
VAGAS LIMITADAS!
ESPAÇO ENFERMAGEM
3221-9156
CAP - CENTRO DE APERFEIÇOAMENTO PROFISSIONAL | ESPAÇO ENFERMAGEM
ESPECIALIZAÇÕES NA ÁREA DE SAÚDE PARA ENFERMEIROS, MÉDICOS, FISIOTERAPEUTAS E PROFISSIONAIS DE CIÊNCIAS BIOLOGICAS.
TODOS OS CURSOS RECONHECIDOS E AUTORIZADOS PELO MEC COM OS PROFISSIOINAIS MAIS CONCEITUADOS DO BRASIL
WWW.ESPACOENFERMAGEM.COM.BR
MATRIZ RECIFE: (81) 3221-9354
FILIAL MACEIÓ: (82) 3221-9156
Novo|ResponderResponder a todosEncaminhar|ExcluirLixo EletrônicoNão é lixo eletrônicoLimpar ▼
Mover tudo de...
Excluir tudo de...
Marcar tudo nesta pasta como lido
Esvaziar tudo nesta pastaMarcar como ▼
Não lida
Lida
Sinalizadas
Não Sinalizadas
Tentativa de phishingMover para ▼
Caixa de Entrada
Lixo
Rascunhos
Enviados
ExcluídosEsvaziar|
Fechar anúncio © 2010 Microsoft Termos Privacidade Anunciar
Segue nosso informativo de cursos. Em anexo segue a ficha de inscrição; no caso de inscrição, favor preencher a ficha e nos reenviar para garantirmos a vaga.
INSCRIÇÕES ABERTAS P/ OS CURSOS LIVRES:
APERFEIÇOAMENTO EM URGÊNCIA E EMERGÊNCIA - 2ª TURMA
Início: 10 de Dezembro (1 FDS por mês, durante 6 meses)
Carga Horária: 240h
Investimento: 6 x de R$ 110,00
CATETERISMO UMBILICAL
Início: 15, 16 e 17 de outubro
Carga Horária: 40h
Investimento: À vista R$ 380,00 ou em 3 x no cheque
PUNÇÃO VENOSA
Início: 6, 7, 8 e 9 de dezembro
Carga Horária: 40h
Investimento: R$ 150,00
ABORDAGEM SINDRÔMICA
Início: 5, 6 e 7 e 26, 27 e 28 de novembro
Carga Horária: 80h
Investimento: R$ 295,00
PÓS-GRADUAÇÃO:
Pós-graduação em Pediatria e Neonatologia
Início: 22, 23 e 24 de outubro
Carga horária: 432h
Investimento: 15 x de R$ 290,00 ou 20 x de R$ 217,00
Pós-graduação em Enfermagem do Trabalho
Início: 3, 4 e 5 de dezembro
Carga horária: 432h
Investimento: 15 x de R$ 290,00 ou 20 x de R$ 217,00
OBS.: GRUPOS A PARTIR DE 5 PESSOAS, CONCEDEMOS DESCONTO NOS VALORES/MENSALIDADES DOS CURSOS.
VAGAS LIMITADAS!
ESPAÇO ENFERMAGEM
3221-9156
CAP - CENTRO DE APERFEIÇOAMENTO PROFISSIONAL | ESPAÇO ENFERMAGEM
ESPECIALIZAÇÕES NA ÁREA DE SAÚDE PARA ENFERMEIROS, MÉDICOS, FISIOTERAPEUTAS E PROFISSIONAIS DE CIÊNCIAS BIOLOGICAS.
TODOS OS CURSOS RECONHECIDOS E AUTORIZADOS PELO MEC COM OS PROFISSIOINAIS MAIS CONCEITUADOS DO BRASIL
WWW.ESPACOENFERMAGEM.COM.BR
MATRIZ RECIFE: (81) 3221-9354
FILIAL MACEIÓ: (82) 3221-9156
Novo|ResponderResponder a todosEncaminhar|ExcluirLixo EletrônicoNão é lixo eletrônicoLimpar ▼
Mover tudo de...
Excluir tudo de...
Marcar tudo nesta pasta como lido
Esvaziar tudo nesta pastaMarcar como ▼
Não lida
Lida
Sinalizadas
Não Sinalizadas
Tentativa de phishingMover para ▼
Caixa de Entrada
Lixo
Rascunhos
Enviados
ExcluídosEsvaziar|
Fechar anúncio © 2010 Microsoft Termos Privacidade Anunciar
sábado, 25 de setembro de 2010
Metabolismo de Carboidratos
Glicogênese
É o processo bioquímico que transforma a glicose em glicogênio.
Ocorre virtualmente em todos os tecidos animais, mas é proeminente no fígado e músculos (os músculos apresentam cerca de 4 vezes mais glicogênio do que o fígado em razão de sua grande massa).
O músculo armazena apenas para o consumo próprio, e só utiliza durante o exercício quando há necessidade de energia rápida
O glicogênio é uma fonte imediata de glicose para os músculos quando há a diminuição da glicose sangüínea (hipoglicemia).
O glicogênio fica disponível no fígado e músculos, sendo consumido totalmente cerca de 24 horas após a última refeição.
A primeira reação do processo glicolítico é a formação de glicose-6-fosfato (G6P) a partir da fosforilação da glicose. A insulina induz a formação de glicose-1-fosfato pela ação da enzima fosfoglicomutase que isomerisa a G6P. A partir daí, há a incorporação da uridina-tri-fosfato (UTP) que proporciona a ligação entre o C1 de uma molécula com o C4 de outra ligação (catalisada pela enzima glicogênio sintase), formando uma maltose inicial que logo será acrescida de outras, formando um polímero a(1- 4). A ramificação da cadeia ocorre pela ação da enzima ramificadora (amido-1-4,1-6-transglucosidase) que transfere cadeias inteiras para um C6, formando ligações a(1- 6).
O substrato para a síntese de glicogênio é a UDP-glicose;
A enzima Glicogênio sintase necessita de um “primer”, ou seja, um resíduo, por onde começar, o qual deve ser formado por pelo menos quatro moléculas de glicose;
A proteína Glicogenina é a responsável pela formação desta pequena cadeia. A ela se liga o pimeiro resíduo de glicose.
A Glicogênio sintase se liga à cadeia de glicogenina (que permanece unida àquele primeiro resíduo de glicose), estendendo a cadeia.
Quando o glicogênio estiver grande o bastante, a enzima Glicogênio sintase é deslocada.
Quantidade de glicose disponível para o ser humano, levando em considerações as reservas hepáticas e musculares de glicogênio:
Controle Hormonal de Carboidratos
Princípios básicos de regulação da glicemia (nível de glicose plasmática).
Regulação hormonal coordenada, a curto e longo prazo, da neoglicogênese e glicólise hepática.
Regulação hormonal da glicogenólise e glicogenogênese.
Os hormônios glicorreguladores incluem:
insulina,
glucagon,
epinefrina,
cortisol e
hormônio de crescimento
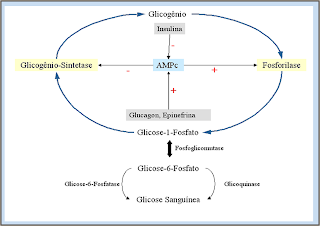
Percurso da glicogenogênese e glicogenólise no fígado
Glicogenólise
O glicogênio pode ser degradado enzimaticamente para a obtenção de glicose para entrar nas rotas oxidativas visando a obtenção de energia.
A glicogenólise possui controle endócrino.
O glicogênio é degradado pela ação conjunta de três enzimas: Glicogênio fosforilase, Enzima α 1,6 glicosidase ou desramificadora de glicogênio e fosfoglicomutase.
Os estímulos possuem como segundo mensageiro o AMP cíclico (AMPc), que é formado a partir do ATP sob ação da enzima adenilato-ciclase (inativa até que haja o estímulo hormonal).
CARBOIDRATOS
1. CONCEITO E IMPORTÂNCIA:
Os carboidratos são também chamados de glucídios, sacarídeos ou simplesmente açúcares.
São as substâncias orgânicas mais abundantes na Terra, devido à suas múltiplas funções nos seres vivos.
Desempenham funções como: fonte imediata ou de reserva de energia para realização de trabalhos celulares; parte integrante de ATP, DNA e RNA; componentes estruturais do arcabouço de células e tecidos vegetais, paredes bacterianas e exoesqueleto de artrópodes.
2. CLASSIFICAÇÃO:
De acordo com a possibilidade de hidrólise, são classificados em quatro grupos:
MONOSSACARÍDEOS: açúcares simples , que não são hidrolisados em unidades menores. Ex: glicose e frutose.
DISSACARÍDEOS: açúcares que por hidrólise fornecem duas moléculas de monossacarídeos iguais ou diferentes entre si. Ex: sacarose e maltose.
OLIGOSSACARÍDEOS: a hidrólise fornece de 3 a 10 moléculas de monossacarídeos. Ex: dextrinas de amido.
POLISSACARÍDEOS: a hidrólise libera acima de 10 unidades de monossacarídeos. Ex:amido e glicogênio.
Os MONOSSACARÍDEOS podem ainda ser classificados em :
Desoxiaçúcares: Ex: Desoxiribose, um componente essencial do DNA.
Aminoaçúcares: apresentam em sua estrutura o grupo amina (NH2). Compõem os GLICOSAMINOGLICANAS.
Açúcares carboxilados: formam ácidos urânicos.
Polióis: são também conhecidos como poliálcoois. Possuem importância comercial como adoçantes em chicletes e doces dietéticos.
3. IMPORTÂNCIA BIOLÓGICA:
Monossacarídeos: combustível celular, produção de energia, componente dos nucleotídeos energéticos. Ex: D- Ribose, D-glicose, D-frutose.
Dissacarídeos: maltose, sacarose e lactose, encontrados na digestão do amido, leite, açúcar de cana ou beterraba.
Polissacarídeos: glicogênio (polissacarídeo de reserva dos animais).
4. USO DA GLICOSE PELAS CÉLULAS:
No interior das células, a glicose pode ter vários destinos:
Degradada a CO2 e H2O, libera toda energia nela contida. Ocorre principalmente no citoplasma (glicólise) e parcialmente nas mitocôndrias (ciclo de Krebs e cadeia respiratória).
Armazenada sob a forma de GLICOGÊNIO (glicogênese), ocorre principalmente em células hepáticas e musculares. Essas reservas de glicogênio são utilizadas (glicogenólise) nos momentos de maior necessidade, como nos intervalos das refeições e durante o exercício físico.
Perdendo CO2 dará origem a pentoses, necessárias à síntese de DNA, RNA e ATP.
Em anaerobiose, o piruvato, produto da degradação da glicose, é convertido à lactato (fermentação lática).
A glicose pode dar ainda origem a produtos especializados (ácido glicurônico, glicosaminas, etc.)
CARBOIDRATOS: VIAS ESPECIAIS
Além das vias clássicas de produção de energia, existem vários outros processos metabólicos envolvendo carboidratos e com diferentes objetivos.
GLICONEOGÊNESE:
A gliconeogênese pode ser definida como a síntese de glicose endógena.
Usada quando há deficiência do suprimento de glicose pela dieta ou por dificuldade na sua absorção pelas células.
É importante para células nervosas e eritrócitos que necessitam continuamente de energia.
O fígado utiliza intensamente essa via para fazer a conversão do lactato em glicose.
CICLO DE CORI
A gliconeogênese é uma condição necessária para o intercâmbio de glicose entre fígado e músculo.
O músculo trabalhando intensamente em anaerobiose gera lactato, que não consegue reverter a glicose em velocidade suficiente.
O lactato é, então, lançado para corrente sanguínea e captado pelo fígado. Através da gliconeogênese será reconvertido em glicose e retorna ao sangue para atender as necessidades energéticas.
É o processo bioquímico que transforma a glicose em glicogênio.
Ocorre virtualmente em todos os tecidos animais, mas é proeminente no fígado e músculos (os músculos apresentam cerca de 4 vezes mais glicogênio do que o fígado em razão de sua grande massa).
O músculo armazena apenas para o consumo próprio, e só utiliza durante o exercício quando há necessidade de energia rápida
O glicogênio é uma fonte imediata de glicose para os músculos quando há a diminuição da glicose sangüínea (hipoglicemia).
O glicogênio fica disponível no fígado e músculos, sendo consumido totalmente cerca de 24 horas após a última refeição.
A primeira reação do processo glicolítico é a formação de glicose-6-fosfato (G6P) a partir da fosforilação da glicose. A insulina induz a formação de glicose-1-fosfato pela ação da enzima fosfoglicomutase que isomerisa a G6P. A partir daí, há a incorporação da uridina-tri-fosfato (UTP) que proporciona a ligação entre o C1 de uma molécula com o C4 de outra ligação (catalisada pela enzima glicogênio sintase), formando uma maltose inicial que logo será acrescida de outras, formando um polímero a(1- 4). A ramificação da cadeia ocorre pela ação da enzima ramificadora (amido-1-4,1-6-transglucosidase) que transfere cadeias inteiras para um C6, formando ligações a(1- 6).
O substrato para a síntese de glicogênio é a UDP-glicose;
A enzima Glicogênio sintase necessita de um “primer”, ou seja, um resíduo, por onde começar, o qual deve ser formado por pelo menos quatro moléculas de glicose;
A proteína Glicogenina é a responsável pela formação desta pequena cadeia. A ela se liga o pimeiro resíduo de glicose.
A Glicogênio sintase se liga à cadeia de glicogenina (que permanece unida àquele primeiro resíduo de glicose), estendendo a cadeia.
Quando o glicogênio estiver grande o bastante, a enzima Glicogênio sintase é deslocada.
Quantidade de glicose disponível para o ser humano, levando em considerações as reservas hepáticas e musculares de glicogênio:
Controle Hormonal de Carboidratos
Princípios básicos de regulação da glicemia (nível de glicose plasmática).
Regulação hormonal coordenada, a curto e longo prazo, da neoglicogênese e glicólise hepática.
Regulação hormonal da glicogenólise e glicogenogênese.
Os hormônios glicorreguladores incluem:
insulina,
glucagon,
epinefrina,
cortisol e
hormônio de crescimento
Percurso da glicogenogênese e glicogenólise no fígado
Glicogenólise
O glicogênio pode ser degradado enzimaticamente para a obtenção de glicose para entrar nas rotas oxidativas visando a obtenção de energia.
A glicogenólise possui controle endócrino.
O glicogênio é degradado pela ação conjunta de três enzimas: Glicogênio fosforilase, Enzima α 1,6 glicosidase ou desramificadora de glicogênio e fosfoglicomutase.
Os estímulos possuem como segundo mensageiro o AMP cíclico (AMPc), que é formado a partir do ATP sob ação da enzima adenilato-ciclase (inativa até que haja o estímulo hormonal).
CARBOIDRATOS
1. CONCEITO E IMPORTÂNCIA:
Os carboidratos são também chamados de glucídios, sacarídeos ou simplesmente açúcares.
São as substâncias orgânicas mais abundantes na Terra, devido à suas múltiplas funções nos seres vivos.
Desempenham funções como: fonte imediata ou de reserva de energia para realização de trabalhos celulares; parte integrante de ATP, DNA e RNA; componentes estruturais do arcabouço de células e tecidos vegetais, paredes bacterianas e exoesqueleto de artrópodes.
2. CLASSIFICAÇÃO:
De acordo com a possibilidade de hidrólise, são classificados em quatro grupos:
MONOSSACARÍDEOS: açúcares simples , que não são hidrolisados em unidades menores. Ex: glicose e frutose.
DISSACARÍDEOS: açúcares que por hidrólise fornecem duas moléculas de monossacarídeos iguais ou diferentes entre si. Ex: sacarose e maltose.
OLIGOSSACARÍDEOS: a hidrólise fornece de 3 a 10 moléculas de monossacarídeos. Ex: dextrinas de amido.
POLISSACARÍDEOS: a hidrólise libera acima de 10 unidades de monossacarídeos. Ex:amido e glicogênio.
Os MONOSSACARÍDEOS podem ainda ser classificados em :
Desoxiaçúcares: Ex: Desoxiribose, um componente essencial do DNA.
Aminoaçúcares: apresentam em sua estrutura o grupo amina (NH2). Compõem os GLICOSAMINOGLICANAS.
Açúcares carboxilados: formam ácidos urânicos.
Polióis: são também conhecidos como poliálcoois. Possuem importância comercial como adoçantes em chicletes e doces dietéticos.
3. IMPORTÂNCIA BIOLÓGICA:
Monossacarídeos: combustível celular, produção de energia, componente dos nucleotídeos energéticos. Ex: D- Ribose, D-glicose, D-frutose.
Dissacarídeos: maltose, sacarose e lactose, encontrados na digestão do amido, leite, açúcar de cana ou beterraba.
Polissacarídeos: glicogênio (polissacarídeo de reserva dos animais).
4. USO DA GLICOSE PELAS CÉLULAS:
No interior das células, a glicose pode ter vários destinos:
Degradada a CO2 e H2O, libera toda energia nela contida. Ocorre principalmente no citoplasma (glicólise) e parcialmente nas mitocôndrias (ciclo de Krebs e cadeia respiratória).
Armazenada sob a forma de GLICOGÊNIO (glicogênese), ocorre principalmente em células hepáticas e musculares. Essas reservas de glicogênio são utilizadas (glicogenólise) nos momentos de maior necessidade, como nos intervalos das refeições e durante o exercício físico.
Perdendo CO2 dará origem a pentoses, necessárias à síntese de DNA, RNA e ATP.
Em anaerobiose, o piruvato, produto da degradação da glicose, é convertido à lactato (fermentação lática).
A glicose pode dar ainda origem a produtos especializados (ácido glicurônico, glicosaminas, etc.)
CARBOIDRATOS: VIAS ESPECIAIS
Além das vias clássicas de produção de energia, existem vários outros processos metabólicos envolvendo carboidratos e com diferentes objetivos.
GLICONEOGÊNESE:
A gliconeogênese pode ser definida como a síntese de glicose endógena.
Usada quando há deficiência do suprimento de glicose pela dieta ou por dificuldade na sua absorção pelas células.
É importante para células nervosas e eritrócitos que necessitam continuamente de energia.
O fígado utiliza intensamente essa via para fazer a conversão do lactato em glicose.
CICLO DE CORI
A gliconeogênese é uma condição necessária para o intercâmbio de glicose entre fígado e músculo.
O músculo trabalhando intensamente em anaerobiose gera lactato, que não consegue reverter a glicose em velocidade suficiente.
O lactato é, então, lançado para corrente sanguínea e captado pelo fígado. Através da gliconeogênese será reconvertido em glicose e retorna ao sangue para atender as necessidades energéticas.
METABOLISMO CELULAR
É a partir dos nutrientes e do oxigênio transportados por via sanguínea, que a atividade biológica das células e do organismo se mantêm, devido às inúmeras reações bioquímicas que ocorrem a cada momento.
O conjunto de reações químicas que ocorrem a nível celular designa-se metabolismo celular.
O metabolismo celular possibilita a formação e degradação de matéria orgânica, bem como a produção de energia sob a forma de ATP (adenosina trifosfato) que, no seu conjunto, são considerados os processos básicos que garantem a vida a qual quer organismo.
O metabolismo celular é dividido em dois grupos de reações químicas:
reações anabólicas e catabólicas
Anabolismo
O anabolismo corresponde ao conjunto de reações químicas em que ocorre a síntese de
moléculas orgânicas complexas a partir de moléculas simples, com consumo de energia, armazenada em moléculas de ATP.
Catabolismo
O catabolismo corresponde ao conjunto de reações de degradação de moléculas orgânicas, para a produção de energia sob a forma de ATP, obtendo-se moléculas mais simples, pobres em energia .
O conjunto de reações químicas que ocorrem a nível celular designa-se metabolismo celular.
O metabolismo celular possibilita a formação e degradação de matéria orgânica, bem como a produção de energia sob a forma de ATP (adenosina trifosfato) que, no seu conjunto, são considerados os processos básicos que garantem a vida a qual quer organismo.
O metabolismo celular é dividido em dois grupos de reações químicas:
reações anabólicas e catabólicas
Anabolismo
O anabolismo corresponde ao conjunto de reações químicas em que ocorre a síntese de
moléculas orgânicas complexas a partir de moléculas simples, com consumo de energia, armazenada em moléculas de ATP.
Catabolismo
O catabolismo corresponde ao conjunto de reações de degradação de moléculas orgânicas, para a produção de energia sob a forma de ATP, obtendo-se moléculas mais simples, pobres em energia .
quarta-feira, 22 de setembro de 2010
quarta-feira, 4 de agosto de 2010
O começo de TUDO!
A Bioquímica tem as suas raízes na história da Química, em particular no interesse do homem em saber que transformações ocorriam nos organismos vivos, responsáveis pela sua origem, crescimento e metamorfose. As questões colocadas por aqueles que procuraram compostos na Natureza que curassem doenças, que se interrogaram sobre a fisiologia do corpo humano, que usaram processos naturais como a fermentação de cervejas e que observaram a decomposição da matéria orgânica, entre outros, lançaram as bases da Bioquímica tal como é conhecida na actualidade.
Talvez o fator crucial para o surgimento da Bioquímica tenha sido a descoberta da primeira enzima em 1833, que na época recebeu o nome "diastase" (hoje chamada "amilase"); quem a descreveu foi Anselme Payen. Em 1896, Eduard Buchner contribuiu para a Bioquímica descrevendo pela primeira vez um complexo processo bioquímico fora da célula - a fermentação alcoólica de extratos celulares de fermento - o que lhe valeu o Prémio Nobel da Química de 1907.
Outro avanço importante na Bioquímica foi a demonstração da natureza proteica das enzimas por James B. Sumner, um assunto anteriormente controverso, ao conseguir cristalizar primeiro a enzima urease e, mais tarde, a catalase. A cristalização de proteínas permitiu a aplicação de técnicas de raios-X para a determinação de estruturas tridimensionais proteicas, algo conseguido pela primeira vez com a enzima lisozima. Mais tarde, e após os estudos de Linus Pauling sobre a natureza da ligação química e a estrutura das hélices alfa proteicas, James Watson, Francis Crick e Maurice Wilkins publicaram a estrutura tridimensional da dupla hélice do DNA.
Embora o termo "bioquímica" tenha sido usado pela primeira vez em 1882, é mais aceito que a criação formal deste termo tenha ocorrido em 1903 pelo químico alemão Carl Neuberg. Anteriormente essa area de ciência era denominada "química fisiológica". Desde a metade do século XX em diante, a bioquímica avançou muito; esse avanço foi possível graças ao desenvolvimento de novas técnicas como a cromatografia, difração de raio X, espectroscopia de ressonância magnética nuclear (RMN), microscopia eletrônica e simulação da dinâmica molecular. Estas técnicas permitiram a descoberta e análise detalhada de moléculas e vias metabólicas celulares, que possibilitaram, por exemplo, elucidar a glicólise ou o ciclo de Krebs (ciclo do ácido cítrico).
Alunos de Enfermagem Fits 2010
Talvez o fator crucial para o surgimento da Bioquímica tenha sido a descoberta da primeira enzima em 1833, que na época recebeu o nome "diastase" (hoje chamada "amilase"); quem a descreveu foi Anselme Payen. Em 1896, Eduard Buchner contribuiu para a Bioquímica descrevendo pela primeira vez um complexo processo bioquímico fora da célula - a fermentação alcoólica de extratos celulares de fermento - o que lhe valeu o Prémio Nobel da Química de 1907.
Outro avanço importante na Bioquímica foi a demonstração da natureza proteica das enzimas por James B. Sumner, um assunto anteriormente controverso, ao conseguir cristalizar primeiro a enzima urease e, mais tarde, a catalase. A cristalização de proteínas permitiu a aplicação de técnicas de raios-X para a determinação de estruturas tridimensionais proteicas, algo conseguido pela primeira vez com a enzima lisozima. Mais tarde, e após os estudos de Linus Pauling sobre a natureza da ligação química e a estrutura das hélices alfa proteicas, James Watson, Francis Crick e Maurice Wilkins publicaram a estrutura tridimensional da dupla hélice do DNA.
Embora o termo "bioquímica" tenha sido usado pela primeira vez em 1882, é mais aceito que a criação formal deste termo tenha ocorrido em 1903 pelo químico alemão Carl Neuberg. Anteriormente essa area de ciência era denominada "química fisiológica". Desde a metade do século XX em diante, a bioquímica avançou muito; esse avanço foi possível graças ao desenvolvimento de novas técnicas como a cromatografia, difração de raio X, espectroscopia de ressonância magnética nuclear (RMN), microscopia eletrônica e simulação da dinâmica molecular. Estas técnicas permitiram a descoberta e análise detalhada de moléculas e vias metabólicas celulares, que possibilitaram, por exemplo, elucidar a glicólise ou o ciclo de Krebs (ciclo do ácido cítrico).
Alunos de Enfermagem Fits 2010
Assinar:
Postagens (Atom)